Hiệu quả của điều trị kết hợp Elbasvir và Grazoprevir trên bệnh nhân viêm gan C mạn kiểu gen 1 tại Bệnh viện đa khoa Kiên Giang
Thuốc chứa elbasvir và grazoprevir được cơ quan quản lý thuốc và thực phẩm Hoa Kỳ phê chuẩn vào năm 2016 cho điều trị viêm gan vi C mạn kiểu gen 1 và 4 ở người lớn. Ở Việt Nam, thuốc nầy (biệt dược Zepatier) được Bộ Y Tế cấp phép cho lưu hành từ tháng 11 năm 2016, tuy nhiên các nghiên cứu dùng thuốc nầy để điều trị viêm gan C mạn vẫn còn ít. Mục đích nghiên cứu là xác định tính hiệu quả của elbasvir kết hợp grazoprevir trong điều trị bệnh nhân viêm gan C mạn kiểu gen 1.
Tóm tắt
Mở đầu và mục đích: Thuốc chứa elbasvir và grazoprevir được cơ quan quản lý thuốc và thực phẩm Hoa Kỳ phê chuẩn vào năm 2016 cho điều trị viêm gan vi C mạn kiểu gen 1 và 4 ở người lớn. Ở Việt Nam, thuốc nầy (biệt dược Zepatier) được Bộ Y Tế cấp phép cho lưu hành từ tháng 11 năm 2016, tuy nhiên các nghiên cứu dùng thuốc nầy để điều trị viêm gan C mạn vẫn còn ít. Mục đích nghiên cứu là xác định tính hiệu quả của elbasvir kết hợp grazoprevir trong điều trị bệnh nhân viêm gan C mạn kiểu gen 1. Phương pháp: Nghiên cứu mô tả tiến cứu, thực hiện tại bệnh viện Đa Khoa Kiên Giang từ 10/2017- 9/2018. Bảy mươi bệnh nhân viêm gan C mạn kiểu gen 1 được điều trị bằng viên kết hợp liều cố định, elbasvir 50mg và grazoprevir 100mg uống trong thời gian 12 tuần và đánh giá đáp ứng vi rút bền vững. Kết quả: Đáp ứng vi rút bền vững (SVR-12) đạt 94,3%, tái phát 5,7%, tác dụng phụ xảy ra ở 25,7% bệnh nhân, tác dụng phụ thường gặp như mệt mỏi (10%), biếng ăn 7,1%, ngứa 4,3%, đau đầu 2,9%, khó ngủ 2,9%. Kết luận: Bệnh nhân viêm gan C mạn kiểu gen 1 điều trị bằng elbasvir 50mg kết hợp grazoprevir 100mg có đáp ứng vi rút bền vững 12 tuần đạt tỷ lệ cao, các tác dụng phụ do thuốc nhìn chung ở mức độ nhẹ.
I. Đặt vấn đề
Nhiễm vi rút viêm gan C là một gánh nặng y tế ở Việt Nam, tỷ lệ hiện nhiễm vi rút nầy vào khoảng 2%-2,9% dân số [5]. Hiện nay, hiệu quả điều trị và tính an toàn của thuốc kháng vi rút tác động trực tiếp điều trị viêm gan C mạn đã được cải thiện đáng kể. Elbasvir kết hợp grazoprevir (biệt dược Zepatier) là thuốc kháng vi rút tác động trực tiếp được cơ quan quản lý thuốc và thực phẩm Hoa Kỳ phê chuẩn vào năm 2016 cho điều trị viêm gan vi rút C mạn kiểu gen 1 và 4 ở người lớn. Ở Việt Nam, thuốc nầy có tên thương mại Zepatier được Bộ Y Tế cấp phép cho lưu hành và sử dụng vào tháng 11 năm 2016 [1], tuy nhiên các nghiên cứu dùng thuốc nầy vẫn còn ít, do đó nhằm góp phần tìm hiểu hiệu quả của thuốc nầy trong điều trị bệnh viêm gan C mạn ở Việt Nam, chúng tôi thực hiện đề tài nầy với mục tiêu:
- Xác định tỷ lệ bệnh nhân viêm gan C mạn được điều trị bằng thuốc elbasvir kết hợp grazoprevir có đáp ứng điều trị.
- Xác định các tác dụng phụ thường gặp của thuốc elbasvir và grazoprevir.
II. Đối tượng và phương pháp nghiên cứu
Đối tượng nghiên cứu: Bệnh nhân người lớn (≥18 tuổi) được chẩn đoán viêm gan C mạn điều trị tại khoa Nhiễm bệnh viện Đa Khoa tỉnh Kiên Giang.
Tiêu chuẩn chọn bệnh: Bệnh nhân viêm gan C mạn, tuổi từ 18 trở lên, kiểu gen vi rút loại 1.
Tiêu chuẩn loại trừ: Xơ gan mất bù (Child-Turcott-Pugh loại B, C), bệnh nhân đã thất bại với phác đồ có thuốc kháng vi rút tác động trực tiếp trước đó, nữ đang có thai.
Thời gian nghiên cứu: Từ tháng 10/2017 đến tháng 9/2018.
Thuốc điều trị: Elbasvir 50mg kết hợp grazoprevir 100mg (biệt dược Zepatier), uống 1 viên mỗi ngày, thời gian điều trị 12 tuần.
Thiết kế nghiên cứu: Phương pháp mô tả tiến cứu.
Kỹ thuật thu thập số liệu: Bệnh nhân được theo dõi và ghi nhận các tác dụng phụ trên lâm sàng và cận lâm sàng ở mỗi 4 tuần tái khám. Đánh giá kết quả đáp ứng vi rút sau 4 tuần, 12 tuần điều trị và đáp ứng vi rút bền vững 12 tuần. Đo tải lượng HCV RNA bằng máy Cobas Taqman 96 hãng Roche, ngưỡng phát hiện thấp nhất là 15 UI/mL và xét nghiệm kiểu gen vi rút ở vùng NS5B do phòng xét nghiệm Medic-Lab Hòa Hảo thực hiện. Phân loại giai đoạn xơ hóa gan dựa trên công thức APRI và điểm Child Turcott Pugh. Mức lọc cầu thận ước tính eGFR (mL/min/1.73 m2) tính theo công thức MDRD.
Tiêu chuẩn đánh giá đáp ứng trong điều trị: Đáp ứng vi rút bền vững ở 12 tuần (SVR-12), bùng phát vi rút, tái phát vi rút [3].
Ngưng trị liệu: Ngưng trị liệu khi bệnh nhân không tuân thủ điều trị, mang thai hoặc có biến cố bất lợi nghiêm trọng xảy ra hoặc xảy ra một trong những biến cố sau: viêm gan bùng phát hoặc có dấu suy gan xuất hiện, nhiễm trùng nặng trên cơ thể, bùng phát vi rút.
Khía cạnh đạo đức: Đề tài được thông qua và chấp thuận bởi hội đồng khoa học kỹ thuật của bệnh viện Đa Khoa Kiên Giang và hội đồng của Sở Y Tế tỉnh. Bệnh nhân tham gia nghiên cứu được Bác sĩ thông tin rõ về mục đích, lợi ích, nguy cơ không mong muốn có thể xảy ra trong quá trình điều trị. Sự tham gia của bệnh nhân là hoàn toàn tự nguyện và ký vào thư đồng ý tham gia.
III. Kết quả nghiên cứu
Có 77 bệnh nhân (bn) được tuyển điều trị. Trong đó, 1 bn có tải lượng vi rút thấp 35 UI/ml được điều trị nhưng không đưa vào lô nghiên cứu. Trong quá trình điều trị có 4 bn ngưng điều trị (gồm 3 bn suy thận mạn đang lọc thận định kỳ không đến nhận thuốc ở tháng thứ 2 do nhà xa; 1 bn suy thận mạn đang lọc thận định kỳ dùng thuốc được 4 tuần thì bị nhiễm trùng huyết đi kèm và tử vong) và 2 bn đã điều trị đủ 12 tuần nhưng không trở lại xét nghiệm đánh giá SVR-12. Tổng số bn tham gia đến kết thúc nghiên cứu là 70 bn.
Đặc điểm chung của bệnh nhân trước điều trị (n=70)
Bảng 3.1. Đặc điểm chung của bệnh nhân trước điều trị
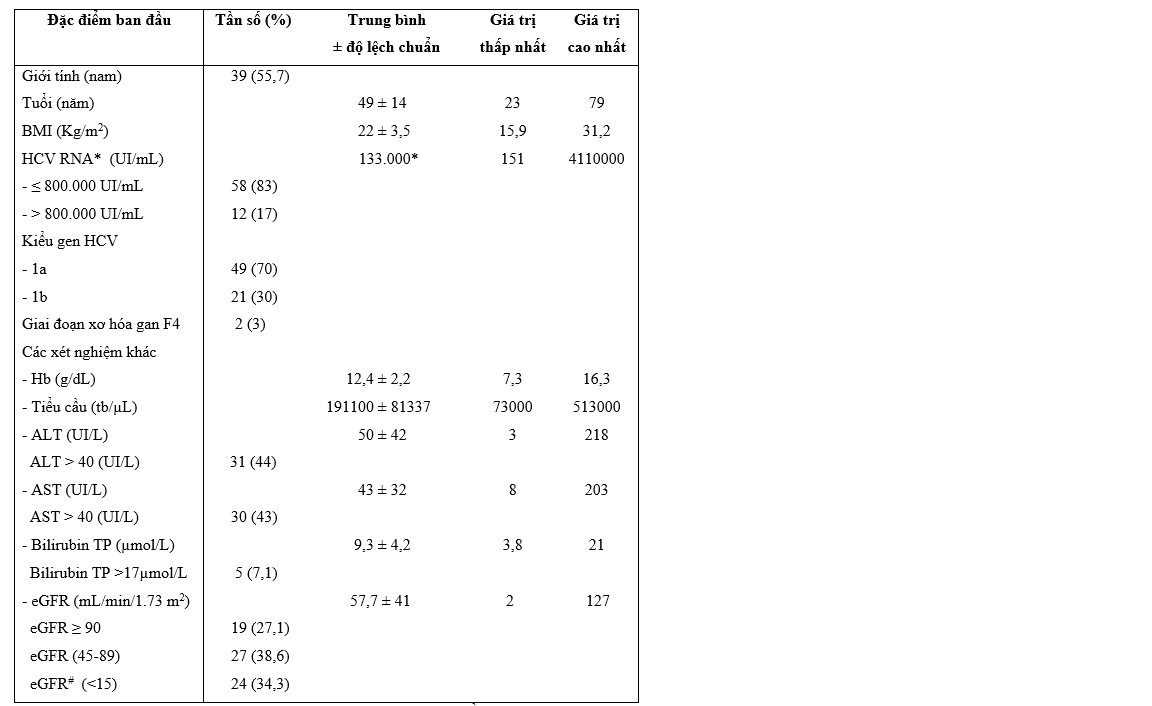
*: HCV RNA trung vị. #: có 24 bn bị suy thận mạn đang điều trị lọc thận định kỳ.
Đáp ứng vi rút trong và sau kết thúc điều trị
Bảng 3.2. Đáp ứng vi rút trong và sau kết thúc điều trị
.jpg)
&: Đáp ứng vi rút bền vững (SVR-12) đạt 94,3%.
Đáp ứng sinh hóa trong và sau kết thúc điều trị
- Tỷ lệ bn có men ALT bình thường sau 12 tuần điều trị là 90% (63/70) và sau khi ngưng điều trị 12 tuần là 91,4%.
- Tỷ lệ bn có men AST bình thường sau 12 tuần điều trị là 91,4% (64/70) và sau khi ngưng điều trị 12 tuần là 94,3%.
Bảng 3.3. Đáp ứng giảm nồng độ men ALT trong và sau điều trị
.jpg)
* : Nồng độ men ALT trung bình ở thời điểm 12 tuần sau điều trị giảm so với nồng độ men ALT trung bình ban đầu (p <0,001).
p**: Nồng độ men ALT trung bình ở thời điểm 12 tuần sau ngưng điều trị giảm so với nồng độ men ALT trung bình ban đầu (p <0,001).
Bảng 3.4. Đáp ứng giảm nồng độ men AST trong và sau điều trị
.jpg)
*: Nồng độ men AST trung bình ở thời điểm 12 tuần sau điều trị giảm so với nồng độ men AST trung bình ban đầu (p<0,001)
p**: Nồng độ men AST trung bình ở thời điểm 12 tuần sau ngưng điều trị giảm so với nồng độ men AST trung bình ban đầu (p<0,001).
Tác dụng phụ thường gặp của thuốc trên lâm sàng trong 12 tuần điều trị
Bảng 3.5. Các tác dụng phụ thường gặp của thuốc trên toàn thân
.jpg)
Tác dụng phụ thường gặp của thuốc trên cận lâm sàng
● Trên chức năng thận sau 12 tuần điều trị
- eGFR trung bình: 56 ± 40 ml/phút/1,73 m2, giá trị nhỏ nhất 2 ml/phút/ 1,73 m2, giá trị lớn nhất 130 ml/phút/1,73 m2;
- eGFR ≥ 90 (ml/phút/1,73 m2) là 16 ca (22,9%); eGFR từ 45-89 chiếm 42,8% và eGFR < 15 là 24 ca chiếm 34,3%.
- eGFR trung bình sau 12 tuần điều trị giảm nhẹ so với eGFR trung bình ban đầu (57,7 ± 41 mL/min/1.73 m2 (nhưng p = 0,2).
● Tác dụng phụ trên chức năng gan mật sau 12 tuần điều trị
- Tỷ lệ bn có nồng độ men ALT tăng > 40 UI/L chiếm 10%, nồng độ men AST tăng > 40 UI/L chiếm 8,6% và bilirubin tp tăng > 17 µmol/L chiếm 4,3%.
Ảnh hưởng của tác dụng phụ trên chế độ điều trị
Không có bn ngưng điều trị do tác dụng phụ của thuốc.
IV. Bàn luận
Đáp ứng vi rút của bn nghiên cứu
Đánh giá kết quả đáp ứng vi rút trong quá trình điều trị có thể giúp thầy thuốc nhận biết được tình trạng bùng phát vi rút, đáp ứng vi rút cuối đợt điều trị hay tái phát. Thông số chính đánh giá kết quả điều trị là đạt đáp ứng vi rút bền vững. Vào năm 2011, cơ quan quản lý thuốc và thực phẩm Hoa Kỳ đã chấp nhận đáp ứng vi rút bền vững ở thời điểm 12 tuần là mục tiêu cho các thử nghiệm lâm sàng.
Kết quả nghiên cứu ghi nhận sau 4 tuần điều trị có 94,2% bn âm tính HCV RNA, đến cuối đợt điều trị 12 tuần 100% bn có HCV RNA âm tính. Sau ngưng điều trị 12 tuần, tỷ lệ bn đạt đáp ứng vi rút bền vững (SVR-12) là 94,3% và có 5,7% bn tái phát. Tham khảo nghiên cứu của Nguyễn Thành Dũng ghi nhận tỷ lệ bn đạt SVR-12 là 100% [2], Theo Kumada H. SVR-12 đạt 96,5% [4].
Đáp ứng sinh hóa trong và sau kết thúc điều trị
Trong điều trị viêm gan C mạn, SVR được xem là thông số chính đánh giá kết quả điều trị, đáp ứng sinh hóa giảm nồng độ men ALT, AST về bình thường được xem là thông số thứ cấp [3]. Kết quả nghiên cứu ghi nhận nồng độ men ALT, AST trung bình ở cuối tuần 12 và sau ngưng thuốc 12 tuần giảm có ý nghĩa thống kê so với nồng độ men ALT, AST trung bình ban đầu (p<0,001). Tỷ lệ bn có men ALT, AST giảm về bình thường (<40 UI/L) ở cuối tuần 12 lần lượt là 90% và 91,4%. Tham khảo nghiên cứu Nguyễn Thành Dũng nồng độ men ALT trung bình sau 12 tuần ngưng điều trị là 26 UI/L giảm so với nồng độ men ALT trung bình ban đầu là 80 UI/L [2].
Tác dụng phụ thường gặp của thuốc trên lâm sàng trong 12 tuần điều trị
Kết quả nghiên cứu ghi nhận tác dụng phụ trên toàn thân thường nhẹ và bn dung nạp được. Có 25,7% bn bị ít nhất 1 tác dụng phụ. Tác dụng phụ phổ biến là mệt mỏi (10%), biếng ăn (7,1%), ngứa (4,3%), đau đầu (2,9%), khó ngủ (2,9%), tác dụng phụ đau cơ bắp hay ho khan chiếm 1,4%. Tham khảo nghiên cứu của Kumada H. ghi nhận bn có ít nhất một tác dụng phụ chiếm 64,8% và viêm mũi họng là tác dụng phụ phổ biến 15% [4], nghiên cứu Zeuzem S. bn có ít nhất một tác dụng phụ là 67%, đau đầu là triệu chứng phổ biến 17%, mệt mỏi chiếm 16% [6].
Tác dụng phụ thường gặp của thuốc trên cận lâm sàng
● Trên chức năng thận: Mức lọc cầu thận ước tính (eGFR) trung bình của bn sau 12 tuần điều trị là: 56 ± 40 ml/phút/1,73 m2 giảm không có ý nghĩa thống kê so với eGFR trung bình ban đầu là 57,7 ± 41 mL/min/1.73 m2 với p = 0,2. Tỷ lệ bn có eGFR giảm < 90 (ml/phút/1,73 m2) sau 12 tuần điều trị chiếm tỷ lệ 77,1% so với trước điều trị eGFR giảm < 90 (ml/phút/1,73 m2) là 72,9%.
● Trên chức năng gan mật: Sau 12 tuần điều trị tỷ lệ bn có nồng độ ALT, AST tăng > 40 UI/L chiếm tỷ lệ lần lượt là 10%, 8,6%, và bilirubin tp tăng chiếm 4,3%. Tham khảo nghiên cứu của Kumada H. cũng ghi nhận tỷ lệ bn có men ALT tăng chiếm 7,4%, AST tăng chiếm tỷ lệ 7% và bilirubin tp tăng là 0,4% [4]. Trong nghiên cứu của Zeuzem S. bn có men ALT tăng chiếm 4,5%, men AST tăng là 5,3% và bilirubin tp tăng chiếm 1,2% [6].
Ảnh hưởng của tác dụng phụ trên chế độ điều trị
Không có bn phải ngưng điều trị do tác dụng phụ của thuốc. Tuy nhiên, có 4 bn phải ngưng điều trị, trong đó 3 bn suy thận mạn đang lọc thận định kỳ không đến nhận thuốc ở tháng thứ 2 do nhà xa, đơn chiết; 1 bn suy thận mạn đang lọc thận định kỳ dùng thuốc được 4 tuần thì bị nhiễm trùng huyết đi kèm và tử vong.
V. Kết luận
Qua điều trị 70 trường hợp viêm gan C mạn bằng elbasvir kết hợp grazoprevir (biệt dược Zepatier), chúng tôi có một số kết luận như sau:
- Đáp ứng vi rút bền vững sau 12 tuần ngưng điều trị đạt tỷ lệ 94,3%.
- Bệnh nhân tái phát chiếm tỷ lệ 5,7%.
- Đáp ứng sinh hóa giảm men ALT, AST sau 12 tuần điều trị lần lượt là 90% và 91,4%. Sau 12 tuần ngưng điều trị tỷ lệ bn có men ALT và AST về bình thường lần lượt là 91,4% và 94,3%.
- Tác dụng phụ thường gặp của thuốc trên lâm sàng trong 12 tuần điều trị là mệt mỏi, biếng ăn, ngứa, đau đầu, khó ngủ.
- Tác dụng phụ thường gặp của thuốc trên cận lâm sàng sau 12 tuần điều trị là men ALT tăng chiếm 10%, men AST tăng là 8,6%, bilirubin tp tăng chiếm 4,3%. Tác dụng phụ trên chức năng thận, giảm mức lọc cầu thận ước tính không có ý nghĩa thống kê.
Nhìn chung, các tác dụng phụ của thuốc nhẹ và bn chịu đựng được.
- . Bộ Y Tế (2016), “Hướng dẫn chẩn đoán và điều trị bệnh viêm gan vi rút C”, Quyết định số 5012/QĐ-BYT.
- . Nguyễn Thành Dũng, (2017), “Hiệu quả điều trị viêm gan C bằng các thuốc kháng vi rút trực tiếp tại bệnh viện Nhiệt Đới”, www.bvbnd.vn
Tiếng Anh
3. AASLD, IDSA (9/2017), “HCV Guidance: Recommendations for testing, managing, and treating hepatitis C”, Last http:www.hcvguidelines.org.
4. Kumada H, Suzuki Y, Karino Y, et al (2017), “The combination of elbasvir and grazoprevir for the treatment of chronic HCV infection in Japanese patients: a randomized phase II/III study”, Gastroenterology, 52, pp. 520-533.
5. Sievert W, Altraif I, Razavi H.A, et al (2011),“ A system review of hepatitis C virus epidemiology in Asia, Australia and Egypt”, Liver international,31, 2, pp.61-80.
6. Zeuzem S, Ghalib R, Reddy KR, et al (2015), “Grazoprevir-elbasvir combination therapy for treatment–naïve cirrhotic and noncirrhotic patients with chronic HCV genotype 1, 4, or 6 infection: a randomized trial”, Annals of Internal Medicine,163, pp.1-13.
Đỗ Thanh Bình: BS.CKII , Phó Khoa Nhiễm bệnh viện Đa Khoa Kiên Giang
BS Đỗ Hữu Trí : BS.CKII, Phó giám đốc bệnh viện Đa Khoa Kiên Giang

- Optimal Screening Protocol after Liver Transplantation for HCC
- TIẾN BỘ MỚI TRONG PHÒNG TRỊ UNG THƯ GAN Ở VIỆT NAM
- HƯỚNG DẪN CỦA APASL 2024: VỀ CHẨN ĐOÁN & ĐIỀU TRỊ SUY GAN CẤP TRÊN NỀN GAN MẠN
- Khuyến cáo về Chẩn đoán và điều trị Ung thư đường mật vùng rốn gan ở Việt Nam
- KHUYẾN CÁO VỀ CHUYỂN ĐỔI SỐ VÀ TRÍ TUỆ NHÂN TẠO (AI) TRONG BỆNH LÝ GAN MẬT TỤY Ở VIỆT NAM
- Chiến lược điều trị Viêm gan virus B hiện nay
- Cập nhật tình hình Viêm gan Virus trên toàn cầu và các chính sách, khuyến cáo mới của WHO
- Chung tay Phòng trị Viêm gan và Ung thư gan tại Việt Nam
- Ứng dụng tiến bộ mới các dấu ấn sinh học virus và sự phát triển thuốc điều trị viêm gan B
- Modern Radiation Therapy Techniques in the Management of Liver Cancer – Pros & Cons : Proton, SBRT, and Y-90 microspheres
- Cập nhật xu hướng ứng dụng chuyển đổi số trong quản lý bệnh lý gan mạn tính trên thế giới và tại việt nam
- Cập nhật quản lý bệnh nhân Viêm gan virus B mạn
- “Đừng bỏ lỡ mục tiêu” “Don’t miss the target” chủ đề của ngày viêm gan thế giới 2023
- The Measures against hepatitis in Japan & future direction of measures against hepatitis in Vietnam
- Mang dịch vụ chăm sóc viêm gan đến gần hơn với cộng đồng – chúng ta đang ở đâu?
- CẬP NHÂT ĐIỀU TRỊ VIÊM GAN THEO HƯỚNG DẪN APASL 2023
- New HCC Screening Biomarkers Dr.Caviglia
- Cập nhật tình hình viêm gan vi rút trên toàn cầu và Việt Nam Chiến lược của WHO và quốc gia
- Advancement in cholangiocarcinoma management
- Hepatitis and Cirrhosis - the Pathway to Hepatocellular Carcinoma
- Liver transplantation in national children hospital
- living donor liver transplantation in Vinmec hospital
- Utility of HBcrAg in the diagnosis and prognosis of Hepatitis B progression
- Tối ưu hóa quản lý viêm gan virus B mạn hiện nay
- Giải phẫu bệnh trong chẩn đoán phân biệt HCC với các tổn thương tế bào gan dạng nốt
Tin cùng loại

 VN
VN
 EN
EN